CHUYÊN ĐỀ PROTEIN GAI: TỔN THƯƠNG & ĐIỀU TRỊ (P.3)

Sự tồn tại của protein gai trong cơ thể có liên quan chặt chẽ đến hội chứng COVID kéo dài và hậu chích vaccine. Tác động của protein gai từ vaccine mRNA COVID-19 đối với sức khỏe con người đang là chủ đề ngày càng được quan tâm gần đây. Trân trọng giới thiệu với quý độc giả Chuyên đề 17 phần về Protein gai: Những tổn thương và những cập nhật về điều trị.
Phần 3: TIN ĐỘC QUYỀN – Protein gai có thể tạo ra huyết khối bất thường
Trong bài viết gồm hai phần này, chúng tôi mong muốn cung cấp thông tin tổng quan về tình trạng huyết khối bất thường liên quan đến COVID-19, cách chúng hình thành, cách phát hiện sớm và cách điều trị.
Các huyết khối bất thường
Kể từ giữa năm 2021, trên toàn thế giới, nhiều chuyên gia ướp xác đã báo cáo về sự xuất hiện của các sợi xơ huyết dài bất thường trong mạch máu của bệnh nhân COVID-19 và những người đã chích ngừa.

“Với tư cách là chuyên gia ướp xác, chúng tôi đang chứng kiến sự xuất hiện của một số huyết khối kỳ lạ kể từ khi đại dịch COVID bùng phát. Trong quá trình ướp xác, chúng tôi sử dụng một ống để rút máu ra khỏi tĩnh mạch, và những huyết khối này khi thoát ra có cảm giác rất dẻo và dài. Chúng thực sự trông như những con giun đất. Tôi chưa từng trông thấy điều này trước đây,” ông Larry Mills, một nhà ướp xác và là giám đốc tang lễ được cấp phép ở tiểu bang Alabama, nói với The Epoch Times.
Một số chuyên gia ướp xác giấu tên khác cũng xác nhận về tình trạng này.
Ông Richard Hirschman, giám đốc nhà tang lễ Alabama và là chuyên gia ướp xác kể từ năm 2001, là một trong những người đầu tiên chú ý đến hiện tượng này. Ông nói rằng, trước khi COVID xuất hiện, có lẽ 5 đến 10% tử thi có xuất hiện những huyết khối này. Nhưng hiện tại, ông nhìn thấy chúng ở hơn một nửa số thi thể.
Một nhà ướp xác khác được cấp phép từ năm 2001 cho biết trong một cuộc phỏng vấn: “Tôi có thể chắc chắn rằng những huyết khối mà ông Richard nhắc đến trên mạng là một hiện tượng mà tôi chưa từng chứng kiến trước đây, chỉ cho đến giữa năm ngoái. Đó là tất cả những gì tôi biết. Tôi không biết nguyên nhân gây ra huyết khối, nhưng chúng dường như bắt đầu xuất hiện vào khoảng giữa năm 2021.”
Vậy thì, những sợi xơ huyết kỳ lạ này là gì, chúng đến từ đâu và hình thành như thế nào?
Một bệnh lý với hơn 200 triệu chứng
Ngay từ những ngày đầu của đại dịch, nhiều bác sĩ đã biết COVID-19 không chỉ là một bệnh lý về phổi, mà còn là bệnh liên quan đến nội mô và mạch máu.
Các bác sĩ đã tổng hợp một danh sách các triệu chứng lâm sàng bất thường của COVID-19, bao gồm tình trạng thiếu oxy trầm trọng (oxy trong mô thấp) mặc dù độ giãn nở của phổi tương đối bình thường khi thăm khám, biến chứng huyết khối và kết quả khám nghiệm tử thi cho thấy sự xuất hiện của huyết khối trong vi tuần hoàn phổi.
Sau khi nhiễm COVID-19 cấp tính, đã có báo cáo về hơn 200 triệu chứng kéo dài khác nhau, thuộc hội chứng COVID kéo dài và có thể tồn tại từ 6–24 tháng.
Đây có lẽ là bệnh lý y khoa có số lượng triệu chứng lớn nhất từ trước đến nay.
Các triệu chứng thường gặp bao gồm khó thở, mệt mỏi, sương mù não, rối loạn chức năng nhận thức, đau nhức cơ, khó ngủ và trầm cảm.
Đặc điểm tái phát và kinh niên của COVID kéo dài chủ yếu gây ra bởi tình trạng rối loạn điều hòa miễn dịch, tình trạng viêm quá mức, căng thẳng oxy hóa và rối loạn chức năng ty thể.
Nhưng tại sao tình trạng này lại xuất hiện? Một số manh mối đã lộ diện kể từ năm 2020.
Tình trạng huyết khối là nguyên nhân gây ra triệu chứng
Vào tháng 11/2020, một báo cáo cho biết các bệnh nhân COVID-19 có sự gia tăng vi huyết khối so với những người khỏe mạnh hoặc bệnh nhân tiểu đường. Điều này giải thích tại sao họ có tình trạng khó thở, mệt mỏi và hội chứng khó chịu sau gắng sức.
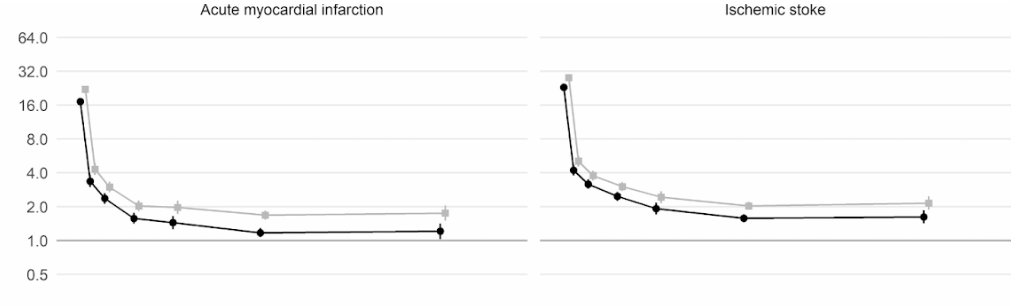
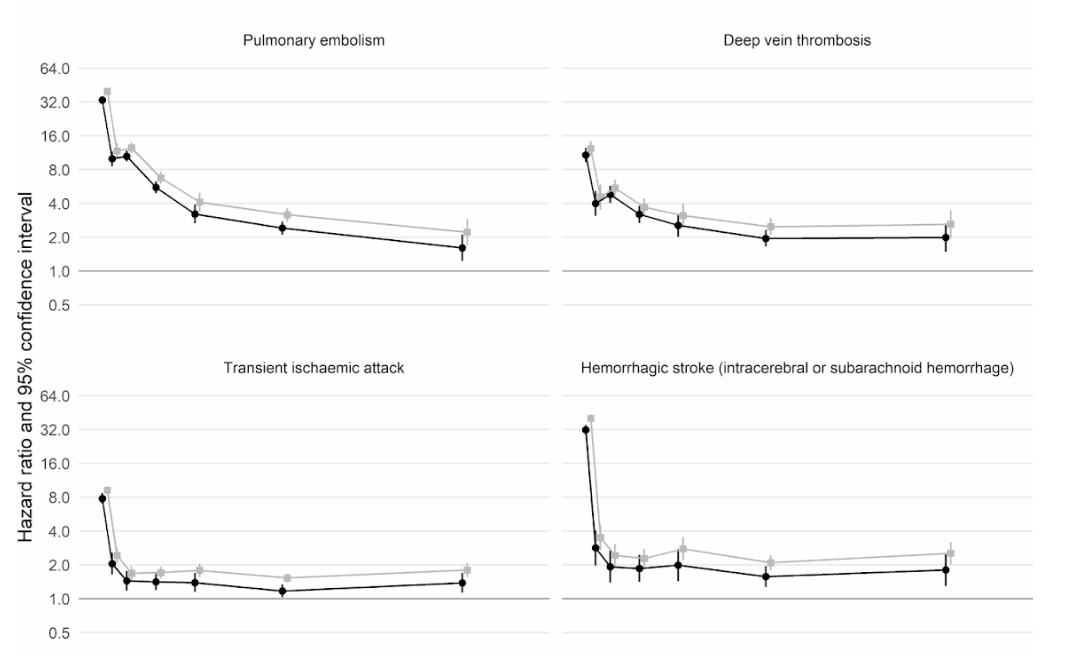
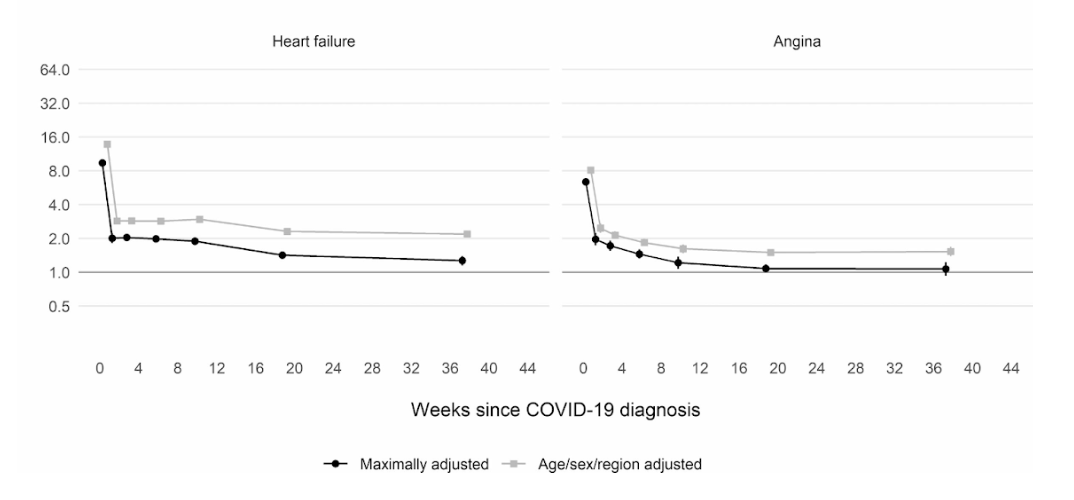
Ngoài ra, một nghiên cứu thuần tập quy mô lớn của Vương quốc Anh dựa trên thông tin từ 48 triệu người trưởng thành ở Anh và xứ Wales đã phát hiện, trong tuần đầu tiên sau khi nhiễm COVID-19, bệnh nhân có nguy cơ hình thành huyết khối trong động mạch cao hơn gần 22 lần so với bình thường, và cao hơn 33 lần nếu người này có bệnh huyết khối tĩnh mạch kèm theo.
Huyết khối động mạch là loại có thể dẫn đến cơn đau tim hoặc đột quỵ thiếu máu cục bộ do ngăn chặn lưu lượng máu đến tim hoặc não.
Từ đó, người ta ước tính rằng có thể có thêm 10,500 trường hợp gặp các vấn đề về huyết khối, với khoảng 7,200 trường hợp bị đau tim hoặc đột quỵ và 3,500 trường hợp bị thuyên tắc phổi, huyết khối tĩnh mạch sâu hoặc các vấn đề về tĩnh mạch.
Mặc dù nguy cơ giảm mạnh xuống khoảng bốn lần ở những người không còn nhiễm COVID trong tuần thứ hai, nhưng vẫn ở mức cao (2 lần) thậm chí cho đến 49 tuần sau đó. Đặc biệt, biến chứng nguy hiểm có thể gặp là bệnh huyết khối tĩnh mạch sâu, là tình trạng hình thành những huyết khối trong tĩnh mạch lớn.
Ngoài ra, một nghiên cứu thuần tập quy mô lớn của Vương quốc Anh dựa trên thông tin từ 48 triệu người trưởng thành ở Anh và xứ Wales đã phát hiện, trong tuần đầu tiên sau khi nhiễm COVID-19, bệnh nhân có nguy cơ hình thành huyết khối trong động mạch cao hơn gần 22 lần so với bình thường, và cao hơn 33 lần nếu người này có bệnh huyết khối tĩnh mạch kèm theo.
Huyết khối động mạch là loại có thể dẫn đến cơn đau tim hoặc đột quỵ thiếu máu cục bộ do ngăn chặn lưu lượng máu đến tim hoặc não.
Từ đó, người ta ước tính rằng có thể có thêm 10,500 trường hợp gặp các vấn đề về huyết khối, với khoảng 7,200 trường hợp bị đau tim hoặc đột quỵ và 3,500 trường hợp bị thuyên tắc phổi, huyết khối tĩnh mạch sâu hoặc các vấn đề về tĩnh mạch.
Mặc dù nguy cơ giảm mạnh xuống khoảng bốn lần ở những người không còn nhiễm COVID trong tuần thứ hai, nhưng vẫn ở mức cao (2 lần) thậm chí cho đến 49 tuần sau đó. Đặc biệt, biến chứng nguy hiểm có thể gặp là bệnh huyết khối tĩnh mạch sâu, là tình trạng hình thành những huyết khối trong tĩnh mạch lớn.
Knight R, Walker V, Ip S, Cooper JA, Bolton T, Keene S, Denholm R, Akbari A, Abbasizanjani H, Torabi F, Omigie E, Hollings S, North TL, Toms R, Jiang X, Angelantonio ED, Denaxas S, Thygesen JH, Tomlinson C, Bray B, Smith CJ, Barber M, Khunti K, Davey Smith G, Chaturvedi N, Sudlow C, Whiteley WN, Wood AM, Sterne JAC; CVD-COVID-UK/COVID-IMPACT Consortium and the Longitudinal Health and Wellbeing COVID-19 National Core Study. Association of COVID-19 With Major Arterial and Venous Thrombotic Diseases: A Population-Wide Cohort Study of 48 Million Adults in England and Wales. Circulation. 2022 Sep 20;146(12):892-906. doi: 10.1161/CIRCULATIONAHA.122.060785. Epub 2022 Sep 19. PMID: 36121907; PMCID: PMC9484653.
Hiệu ứng Domino của protein gai
Máu là một dạng chất lỏng lưu thông dưới áp lực trong lòng mạch máu của toàn bộ cơ thể, tương tự như dòng nước chảy trong nhà mà chúng ta sử dụng để vệ sinh, tắm rửa, v.v.
Nếu mạch máu bị tổn thương, lượng máu “rò rỉ” sẽ nhanh chóng chuyển thành dạng gel (“huyết khối”) để ngăn chặn vết thương và giảm mất máu.
Thông thường, phần huyết tương trong máu chứa một loạt protein hòa tan có tác dụng kích hoạt enzym hình thành fibrin huyết khối. Quá trình này sẽ giúp ngăn ngừa mất máu sau tổn thương, từ đó bảo vệ cơ thể.
Thật không may, cơ chế đông máu cũng có thể dẫn đến huyết khối không mong muốn trong lòng mạch (huyết khối bệnh lý), gây ra đau tim hoặc đột quỵ, hai nguyên nhân hàng đầu dẫn đến tàn tật và tử vong trên thế giới.
Cách thức tạo ra huyết khối bất thường của COVID-19 là chủ đề đã được thảo luận sôi nổi kể từ đầu năm 2020.
Có vẻ như, protein gai đặc biệt của virus đã kích hoạt một cơ chế đông máu theo những con đường “phi truyền thống.”
Sự xâm nhập trực tiếp của protein gai vào tế bào biểu mô giống như tấm domino đầu tiên bị lật đổ.
Các hiệu ứng liên tiếp sau đó được kích hoạt và cuối cùng dẫn đến hiện tượng đông máu.
Protein gai làm suy yếu tế bào biểu mô
SARS-CoV-2 có thể xâm nhập vào tế bào nhờ gắn với thụ thể protein angiotensin-converting enzyme 2 (ACE2).
Các tế bào nội mô (ECs) chứa rất nhiều thụ thể ACE2. Tế bào nội mô được lót bên trong mạch máu của cơ thể, khiến chúng trở thành mục tiêu tấn công trực tiếp của virus.
Nhiều nghiên cứu cho thấy bản thân protein gai có thể làm hỏng cấu trúc và chức năng của tế bào nội mô, như làm suy yếu ti thể và giảm điều hòa phân tử bảo vệ ACE2 trên tế bào.
Các nhà nghiên cứu quan sát thấy cả hai tiểu phần S1 và S2 của protein gai có thể làm tế bào nội mô biểu hiện lượng lớn các cytokine gây viêm (IL6, IL1B, TNF-alpha và chemokine CXCL1 và CXCL2).
Sau đó, việc phóng thích cytokine sẽ kích hoạt phân tử E-selectin trên màng tế bào nội mô, cho phép protein gai gắn vào tế bào miễn dịch, từ đó bắt đầu quá trình bệnh lý tiếp theo.
Một số nghiên cứu bổ sung cho thấy protein gai có thể kích hoạt tình trạng viêm tế bào nội mô phụ thuộc con đường truyền tín hiệu integrin ⍺5β1 và NF-κB, sau đó kích hoạt sự biểu hiện của các phân tử kết dính bạch cầu.
Cytokine là những protein có kích thước nhỏ được tiết ra bởi tế bào (chủ yếu là tế bào T và đại thực bào). Mỗi cytokine có một tên cụ thể và đóng vai trò như thiết bị liên lạc giữa các tế bào (tín hiệu tế bào) để thực hiện hoạt động cụ thể. Cytokine là “người đưa thư” giúp tế bào kết nối và giao tiếp với nhau.
Protein gai có thể phá vỡ những protein kết nối này giữa các tế bào nội mô, làm rối loạn tính toàn vẹn và chức năng của mạch máu.
Tế bào nội mô ở não cũng chứa nhiều thụ thể ACE2. Protein gai có thể phá hủy tế bào nội mô não, gây ra triệu chứng thần kinh như sương mù não và suy giảm nhận thức.
Protein gai kích hoạt dòng thác đông máu
Nhiều loại tế bào, bao gồm tế bào biểu mô phổi, tế bào lót ruột non và tế bào ngoại mạch tim, đều chứa ACE2.
Không chỉ có tác dụng kích hoạt tế bào biểu mô (EC) và đẩy nhanh quá trình viêm cục bộ, protein gai còn gây ra viêm toàn thân, do ACE2 có mặt ở hầu hết các mô cơ quan chủ yếu trong cơ thể.
Nhiều gen gây viêm theo đó được biểu hiện. Các tế bào miễn dịch sau đó di chuyển đến các mô bị thương hoặc bị nhiễm bệnh (tại mạch máu ở phổi, tim, ruột, v.v.).
Một số biến cố tiếp theo có thể góp phần tạo ra dòng thác đông máu:
- Viêm biểu mô qua trung gian bổ thể (viêm nội mô): Protein gai gắn vào ACE2 trên tế bào nội mô, kích hoạt con đường bổ thể và dòng thác đông máu, dẫn đến viêm nội mô hệ thống (tổn thương tại phổi) và trạng thái tiền đông máu (xu hướng hình thành huyết khối).
- Khi bổ thể phá hủy lớp nội mô, yếu tố von Willebrand gây đông máu (vWF) và FVIII được phóng thích. Sự gia tăng đáng kể của vWF có thể hình thành các multimer, từ đó đẩy nhanh quá trình hình thành huyết khối. vWF được tiết ra chủ yếu từ tế bào nội mô và các hạt a của tiểu cầu (có nguồn gốc từ tế bào nhân khổng lồ). Có thể coi tế bào nhân khổng lồ là một chuỗi hạt và tiểu cầu là một hạt trong số đó.
- Cơn bão tiểu cầu: Tiểu cầu là một mảnh nhỏ của tế bào nhân khổng lồ. Các độc tố phản vệ C3a và C5a của bổ thể có thể kích hoạt tiểu cầu và làm tăng sản xuất yếu tố mô giúp đẩy nhanh quá trình hình thành huyết khối. Các thụ thể ACE2 trên tiểu cầu cũng có thể dẫn đến sự kết tập tiểu cầu với số lượng lớn, một đặc trưng của bệnh lý COVID-19 mức độ nặng.
- Kích hoạt bạch cầu trung tính dẫn đến hình thành các bẫy ngoại bào bạch cầu trung tính (NET), một quá trình đôi khi được gọi là NETosis, cũng góp phần hình thành huyết khối.
- Tổn thương tế bào nội mô do RNA của virus kích hoạt toll-like receptor (TLR) có thể làm tăng sản xuất các dạng oxy hóa phản ứng (ROS). ROS tăng lên sẽ làm tăng điều hòa biểu hiện của vWF.
- Protein gai có thể làm tăng biểu hiện và bài tiết của một loạt protein gây ra dòng thác đông máu, bao gồm yếu tố (F)-V, thrombin và fibrinogen để đẩy nhanh quá trình đông máu.
Protein gai làm rối loạn RAAS và khiến tình trạng đông máu tệ hơn
Do protein gai tương tác trực tiếp với ACE2, bệnh nhân COVID-19 thường có nồng độ angiotensin II trong huyết thanh tăng cao, cho thấy sự rối loạn điều hòa của hệ RAA (hệ thống renin angiotensin aldosterone, hay RAAS).
Thông thường, người ta cho rằng angiotensin II là một hormone thần kinh kích thích sự co thắt của tế bào cơ trơn mạch máu và chịu trách nhiệm cân bằng muối và nước.
Tuy nhiên, nhiều nghiên cứu cho thấy angiotensin II có khả năng khởi phát và tăng điều chỉnh các phản ứng viêm, làm trầm trọng thêm tình trạng đông máu.
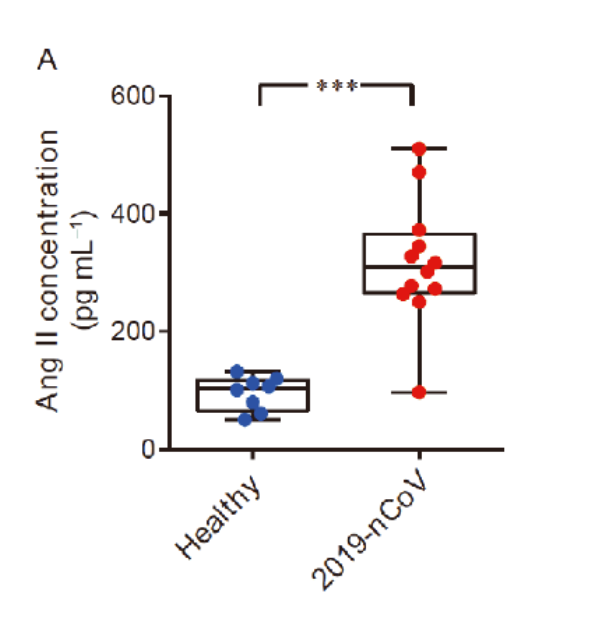
Trong một phản ứng miễn dịch, các cơ chế điều hòa và tự giới hạn của cơ thể có thể làm dịu vết thương tại chỗ, chữa lành tổn thương và giúp tế bào nội mô trở lại trạng thái bình thường.
Tuy nhiên, với những bệnh nhân dễ bị COVID-19 hoặc những người đã chích ngừa, yếu tố làm tăng hình thành huyết khối chiếm ưu thế hơn so với cơ chế chữa lành, dẫn đến dòng thác huyết khối ngày càng leo thang.
Dưới đây là bản tổng hợp ngắn gọn về quá trình hình thành huyết khối: sự gián đoạn nội mô do protein gai, một lượng lớn vWF được phóng thích, cơn bão tiểu cầu xuất hiện sau đó, tình trạng thiếu oxy mô gây tăng điều hòa và kích hoạt vWF, mạng lưới sợi từ bẫy ngoại bào bạch cầu trung tính (NETs), cũng như sự tăng nồng độ angiotensin II, tất cả cộng gộp lại để tạo ra các huyết khối.
Đó là cách huyết khối được hình thành. Ngoài ra, quá trình thứ hai cũng chiếm một phần quan trọng không kém.
Vaccine COVID khiến tế bào tạo ra lượng lớn protein gai. Quá trình sinh hóa và sinh lý bình thường bị “chiếm quyền điều khiển” để sản xuất một lượng lớn protein gai bất thường.
Đáng nói, lượng protein gai bất thường này có tác động trực tiếp đến tình trạng huyết khối theo những cách không thể ngờ.
Protein gai trực tiếp phá vỡ cơ chế làm tan huyết khối
Ở một người khỏe mạnh bình thường, huyết khối xuất hiện một thời gian sẽ bị phá hủy nhờ vào quá trình tiêu sợi huyết. Đây là cơ chế chữa lành và cân bằng tự nhiên của cơ thể, giúp ngăn ngừa hình thành quá nhiều huyết khối.
Trong quá trình này, chất kích hoạt plasminogen mô (TPA, đến từ lớp nội mô) sẽ biến plasminogen thành plasmin, sau đó tạo ra d-dimer (một đoạn protein nhỏ còn lại sau quá trình tiêu huyết khối).
Người ta phát hiện fibrinogen trong máu có thể đông lại thành một dạng fibrin “amyloid” bất thường (giống amyloid β và prion), từ đó kháng lại sự thủy phân protein (tiêu sợi huyết) một cách tương đối.
Tình trạng này thường xảy ra ở những người mắc COVID kéo dài có huyết tương nghèo tiểu cầu (PPP – platelet-poor plasma). Theo đó, các vi khối fibrin amyloid này có thể tồn tại dai dẳng.
Trong một nghiên cứu nổi bật của Grobbelaar được công bố trên Báo cáo Khoa học Sinh học vào tháng 8/2021, bản thân dấu ấn sinh học S1 (hoặc phần xâm nhập của protein gai) có thể kháng lại fibrin của quá trình tiêu sợi huyết, dẫn đến hình thành vi huyết khối.
Khi được đưa vào cơ thể người khỏe mạnh có huyết tương nghèo tiểu cầu, protein gai S1 có thể làm thay đổi cấu trúc của β và γ fibrinogen, bổ thể 3 và prothrombin. Những protein này về cơ bản có khả năng chống lại quá trình trypsin hóa khi có mặt protein gai S1.
Do đó, kết quả cho thấy sự hiện diện của protein gai trong tuần hoàn có thể góp phần làm tăng đông máu và làm suy yếu đáng kể quá trình tiêu huyết khối.
Sự suy giảm quá trình phân giải này có thể khiến các vi huyết khối có kích thước lớn tồn tại dai dẳng bên trong lòng mạch, một hiện tượng đã được báo cáo và tìm thấy trong mẫu huyết tương của bệnh nhân COVID-19.
Những vi huyết khối này làm tắc nghẽn mao mạch, hạn chế sự di chuyển của hồng cầu và do đó làm giảm quá trình trao đổi oxy, từ đó gây ra phần lớn các triệu chứng ở người bệnh.
Protein gai tạo ra dạng chất giống Amyloid
Hơn nữa, trước sự ngạc nhiên của nhiều người, protein gai được xác nhận là có mặt trong bảy trình tự của amyloidogen và có thể tạo ra các chất giống amyloid.
Nói cách khác, protein gai cũng tương tự như beta-amyloid, tau hoặc alpha-synuclein, những chất có thể phá hủy tế bào thần kinh ở bệnh nhân Alzheimer hoặc Parkinson.
Protein gai rất dễ hình thành cấu trúc gắn dạng chuỗi chặt chẽ với xoắn dọc cũng như gắn chéo, tạo thành cấu trúc dạng sợi có thể nhìn thấy dưới kính hiển vi.
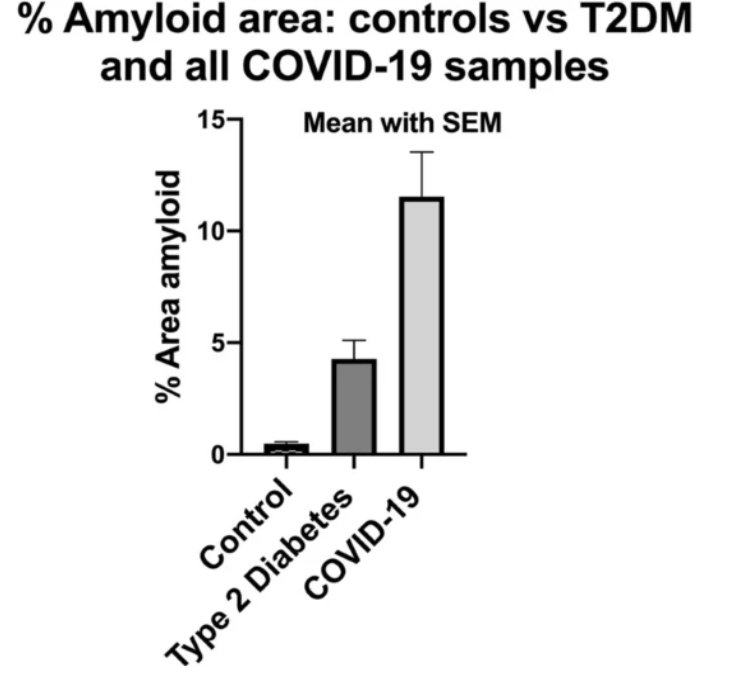
Nhiều nhà nghiên cứu phát hiện mẫu huyết tương của bệnh nhân COVID kéo dài có chứa lượng lớn chất lắng đọng bất thường (amyloid), có thể chống lại quá trình tiêu sợi huyết (so với huyết tương của bệnh nhân đối chứng và bệnh tiểu đường), ngay cả sau quá trình trypsin hóa (là quá trình phân ly tế bào bằng cách sử dụng trypsin, một loại enzyme phân giải protein có tác dụng phá vỡ protein).
Sau lần trypsin hóa thứ hai, các chất lắng đọng dai dẳng (vi huyết khối) có thể bị tiêu đi. Ở bệnh nhân COVID-19, nhiều phân tử gây viêm có thể tăng lên đáng kể ở cả phần nổi phía trên và bị giữ lại bên trong phần lắng đọng dạng viên hòa tan khi so với phân tử của nhóm đối chứng.
Một điều cần quan tâm là, các viên lắng đọng kháng fibrin dạng hòa tan này có chứa lượng lớn α(2)-antiplasmin (α2AP), các chuỗi fibrinogen, cũng như Amyloid huyết thanh A (SAA).
Khi đó, sự hình thành lượng lớn các vi huyết khối amyloid bất thường này có thể chống lại quá trình tiêu sợi huyết và làm tăng α2AP. Đồng thời, sự gia tăng các phân tử gây viêm giai đoạn cấp tính có thể là nguyên nhân chính dẫn đến nhiễm COVID-19 và hội chứng liên quan đến vaccine COVID.
Protein gai ức chế một cơ chế chống đông khác
Protein gai có thể khiến bạn ngạc nhiên hết lần này đến lần khác.
Đã có báo cáo cho rằng protein gai có thể cạnh tranh với antithrombin và heparin cofactor II để gắn vào heparin, gây ra sự gia tăng bất thường trong hoạt động (đông máu) của thrombin.
Protein gai của SARS-CoV-2 ở nồng độ (~10 μg/mL) tương tự như tải lượng virus ở bệnh nhân nặng có thể trực tiếp gây ra đông máu và tạo ra huyết khối trong mô hình trên cá ngựa vằn.
Nói tóm lại, tác động tiêu cực không mong muốn của protein gai với quá trình tiêu huyết khối, cộng với bản chất amyloid, tất cả có thể là yếu tố chính góp phần gây ra những huyết khối bất thường dạng sợi được quan sát thấy trong các tình trạng liên quan đến COVID.
Những bằng chứng không thể chối cãi
Đã có bằng chứng lâm sàng cho thấy protein gai của SARS-CoV-2 có mặt trong các huyết khối lấy ra từ bệnh nhân COVID-19 bị đột quỵ do thiếu máu cục bộ cấp tính và nhồi máu cơ tim.
Một nghiên cứu gần đây được thực hiện bởi một số bác sĩ tim mạch từ Đại học Colorado đã làm sáng tỏ vai trò quan trọng của protein gai trong bệnh lý của COVID và các tổn thương liên quan đến vaccine COVID.
Nghiên cứu phân tích bảy bệnh nhân COVID-19 và sáu bệnh nhân được chích vaccine mRNA có tình trạng tổn thương cơ tim. Kết quả cho thấy những bệnh nhân này có sự thay đổi gần như tương tự trong các kiểu sao chép gen, khiến họ gặp phải tình trạng đông máu, viêm nhiễm và rối loạn chức năng cơ tim.
Nói cách khác, bất kể viêm cơ tim là do virus hay vaccine gây ra, sự biểu hiện của các gen chịu trách nhiệm về trạng thái tăng đông máu để đáp ứng với protein gai, viêm và rối loạn chức năng cơ tim, đều có những thay đổi tương tự.
Dựa trên phân tích gen, có thể nói COVID-19 và tổn thương sau chích vaccine mRNA có cùng cơ chế phân tử.
Kiểu gen bị thay đổi bao gồm sự giảm điều chỉnh ở ACE2, tỷ lệ ACE2/ACE, AGTR1 và ITGA5, đồng thời tăng điều chỉnh ở ACE và F3 (yếu tố mô).
Điều đáng báo động hơn và chưa được báo cáo trước đó là, huyết khối vi mạch đã được tìm thấy ở những bệnh nhân sau chích vaccine, cho thấy bản thân protein gai có thể gây ra huyết khối ở những cá thể nhạy cảm.
Một phần nổi của tảng băng chìm
Dựa trên mối quan hệ nhân quả giữa vaccine ChAdOx1-S (vaccine AstraZeneca adenovirus COVID) và biến chứng giảm tiểu cầu huyết khối, người ta đã cập nhật biến chứng này vào phần thông tin sản phẩm của ChAdOx1-S như là một tác dụng phụ rất hiếm gặp.
Biến chứng này được gọi là biến chứng giảm tiểu cầu huyết khối miễn dịch do chích vaccine COVID-19 (VITT), do trên thực tế, ở hầu hết bệnh nhân trong báo cáo, các kháng thể kháng yếu tố tiểu cầu 4 (PF4)–phức hợp polyanion xuất hiện trong cơ thể họ với nồng độ cao.
Tình trạng huyết khối bất thường kèm giảm tiểu cầu được báo cáo chủ yếu ở phụ nữ dưới 60 tuổi. Theo đó, một số quốc gia Âu Châu đã hạn chế sử dụng vaccine adenovirus ở nhóm tuổi thấp hơn.
Một nghiên cứu thuần tập mạng lưới quốc tế từ năm quốc gia Âu Châu và Hoa Kỳ gần đây đã phân tích có hệ thống về nguy cơ này. Kết quả cho thấy nguy cơ giảm tiểu cầu tăng khoảng 30% sau liều vaccine ChAdOx1-S đầu tiên. Đồng thời, tình trạng huyết khối tĩnh mạch kèm hội chứng giảm tiểu cầu cũng như xu hướng gia tăng sau khi dùng Ad26.COV2.S (vaccine COVID Janssen) so với BNT162b2 (vaccine Pfizer-BioNTech COVID).
Tuy nhiên đây có thể chỉ là phần nổi của tảng băng chìm. Có nhiều biến cố có thể được quy cho các vấn đề đông máu như đột tử, biến cố tim mạch, tử vong do tim, đột quỵ, tàn tật, biến cố huyết khối, v.v.
Mạch máu có mặt trong mọi cơ quan của chúng ta. Các vấn đề về mạch máu có thể giải thích một loạt triệu chứng, từ rối loạn chức năng đến suy giảm chức năng não bộ, tim, phổi và tứ chi ở mức độ nhẹ.
Thanh Ngọc biên dịch
Quý vị tham khảo bản gốc từ The Epoch Times