FDA chấp thuận vaccine RSV của Pfizer cho phụ nữ mang thai
Khả năng bảo vệ được cho là kéo dài trong 6 tháng

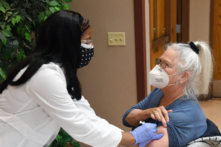
Vào hôm 21/08, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã chấp thuận vaccine đầu tiên cho phụ nữ mang thai nhằm ngăn ngừa nhiễm trùng do virus hợp bào hô hấp (RSV) ở trẻ sơ sinh và trẻ mới biết đi.
Vaccine Abrysvo của Pfizer, là vaccine liều duy nhất đầu tiên chích vào cơ, được chấp thuận sử dụng [cho phụ nữ] trong thai kỳ từ 32 đến 36 tuần.
Theo FDA, phụ nữ mang thai thu được khả năng miễn dịch từ vaccine sẽ truyền khả năng miễn dịch đó cho thai nhi trước khi sinh, giúp bảo vệ trẻ khỏi bệnh đường hô hấp dưới (LRTD) và LRTD nặng do virus RSV gây ra trong ít nhất 6 tháng tuổi.
Việc chấp thuận diễn ra sau cuộc bỏ phiếu nhất trí vào tháng 5 của 14 thành viên trong Ủy ban Tư vấn Vaccine và Sản phẩm Sinh học của FDA (VRBPAC), liên quan đến việc khuyến nghị loại thuốc này cho phụ nữ mang thai để bảo vệ trẻ sơ sinh và trẻ mẫu giáo.
Vaccine Abrysvo cũng được chấp thuận ở những người 60 tuổi trở lên nhằm ngăn chặn virus RSV vào tháng 7.
RSV là virus đường hô hấp phổ biến, thường gây bệnh nhẹ và các triệu chứng như chảy mũi, chán ăn, ho, thở khò khè và sốt ở người lớn khỏe mạnh. Theo CDC, thông thường bệnh nhân sẽ hồi phục sau vài tuần.
Tuy nhiên, virus này đặc biệt phổ biến ở trẻ em, hầu hết trẻ sẽ nhiễm virus RSV khi được 2 tuổi.
Mặc dù tương tự như người lớn, virus RSV thường gây ra các triệu chứng giống cảm lạnh ở trẻ sơ sinh và trẻ nhỏ, nhưng cũng có thể dẫn đến bệnh LRTD nặng như viêm phổi và viêm tiểu phế quản (sưng các đường dẫn khí nhỏ ở phổi).
Theo CDC, mỗi năm virus RSV dẫn đến 2.1 triệu lượt khám ngoại trú và 100-300 ca tử vong ở trẻ dưới 5 tuổi tại Hoa Kỳ.
Tuổi thọ và tác dụng phụ tiềm ẩn của vaccine
Theo thông báo chấp thuận mới nhất, FDA cho biết các nghiên cứu lâm sàng đánh giá hiệu quả của Abrysvo cho thấy thuốc này làm giảm 81.8% nguy cơ bị LRTD nặng trong 90 ngày sau sinh, và 69.4% trong 180 ngày sau sinh.
Nghiên cứu được thực hiện trên khoảng 3,500 phụ nữ mang thai. Theo FDA, đối với phụ nữ mang thai từ 32 đến 36 tuần trong nghiên cứu, Abrysvo làm giảm 34.7% nguy cơ LRTD và 91.1% nguy cơ LRTD nặng trong 90 ngày sau sinh.
Tuy nhiên, FDA cho biết có một số tác dụng phụ đối với phụ nữ mang thai đã chích vaccine, bao gồm đau tại vị trí chích, đau đầu, đau cơ, và buồn nôn.
Ngoài ra, mặc dù không thường được báo cáo, nhưng một chứng rối loạn tăng huyết áp nguy hiểm, gọi là tiền sản giật – tình trạng huyết áp [tăng] trầm trọng đôi khi xuất hiện trong thai kỳ – xảy ra ở 1.8% phụ nữ mang thai chích vaccine Abrysvo so với 1.4% phụ nữ mang thai ở nhóm giả dược.
Tiền sản giật có thể đe dọa đến tính mạng của cả mẹ và thai nhi.
FDA cho biết, “Trong các nghiên cứu an toàn, tình trạng trẻ sơ sinh nhẹ cân và vàng da xảy ra với tỷ lệ cao hơn ở phụ nữ mang thai đã chích Abrysvo so với phụ nữ mang thai đã chích giả dược.”
Tuy nhiên, bà Annaliesa Anderson, phó chủ tịch cao cấp kiêm giám đốc khoa học về nghiên cứu và phát triển vaccine của Pfizer, vẫn ca ngợi việc chấp thuận vaccine Abrysvo là “loại vaccine đầu tiên và duy nhất cho bà mẹ” giúp ngăn chặn virus RSV, gọi đây là “cột mốc quan trọng đối với cộng đồng khoa học và sức khỏe cộng đồng.”
Bà Anderson cho biết, “Chúng tôi vô cùng biết ơn những người tham gia thử nghiệm lâm sàng và các nhóm điều tra nghiên cứu trên thế giới, cũng như các đồng nghiệp Pfizer của chúng tôi, vì cam kết tạo ra loại vaccine này. Hiện tại, mục tiêu mong đợi từ lâu là cung cấp một loại vaccine dành cho bà mẹ nhằm giúp bảo vệ trẻ sơ sinh dưới 6 tháng tuổi – khi trẻ có nguy cơ cao nhất phải chịu những hậu quả trầm trọng có thể xảy ra do RSV – đã đạt được.”
Vân Hi biên dịch
Quý vị tham khảo bản gốc từ The Epoch Times